CAPA System
#1 FDA Finding – Jahr für Jahr
CAPA-Mängel führen die Liste der FDA 483 Observations seit über einem Jahrzehnt an.
"Inadequate CAPA procedures" kostet Unternehmen Zertifizierungen, Kundenvertrauen und Marktzugang.
Das Problem: Die meisten CAPA-Systeme scheitern nicht an fehlenden Dokumenten – sondern an oberflächlicher Ursachenanalyse, unklaren Eskalationskriterien und fehlender Wirksamkeitsprüfung. Auditoren erkennen das sofort.
Die Lösung: Ein durchdachtes System mit klarer Struktur. Diese Anleitung zeigt Ihnen Schritt für Schritt, wie Sie ein CAPA-System aufbauen, das Audits besteht – mit Templates, die Sie sofort einsetzen können.
Scrollen Sie durch die 6 Schritte. Links sehen Sie das jeweilige Dokument als Vorschau, rechts die Erklärung zur Anwendung.
Komplettes CAPA-Bundle v2.0 — sofort einsatzbereit.
Komplett überarbeitet — 13 kritische Audit-Lücken geschlossen
Sichere Zahlung via Gumroad · Sofort-Download
Enthalten:
- ✓7 Dokumente (Word & Excel)
- ✓SOP mit Eskalationsmatrix & Wiedereröffnung
- ✓RCA-Toolkit (5-Why, Ishikawa, Pareto + Methodenauswahl)
- ✓Tracking-Log mit KPI-Dashboard
- ✓Ausgefülltes Beispiel (Katheter-Etikettierung)
- ✓Quick Reference Card + ReadMe
- ✓Firmenweite Lizenz
Den Prozess definieren – CAPA SOP
Warum zuerst die SOP?
Die SOP ist das Fundament Ihres CAPA-Systems. Version 2.0 deckt 11 Abschnitte ab – von NC→CAPA-Kriterien über Lieferanten-CAPA bis zum Wiedereröffnungs-Workflow.
Neu in v2.0:
- • Eskalationsmatrix: Priorität bestimmt automatisch Fristen und Genehmigungsstufen
- • NC→CAPA-Kriterien: Klare Entscheidungstabelle – nicht jede NC braucht ein CAPA
- • Lieferanten-CAPA: Dedizierter Prozess für externe Abweichungen
- • Wiedereröffnung: Definierter Workflow mit Auto-Eskalation bei 2. Wiedereröffnung
- • KPI-Definitionen: Wirksamkeitsrate, Wiederauftretensrate, Termintreue, Vorbeugungsverhältnis
💡 11 Abschnitte – vollständig konform mit ISO 13485 §8.5.2/8.5.3, FDA 21 CFR 820.100 und EU MDR.
CAPAs dokumentieren – Das Formular
Ein Formular pro CAPA
Version 2.0 mit 10 Sektionen – jetzt inkl. Risikomanagement-Akte-Prüfung, FSCA-Bewertung und verpflichtender horizontaler Ausweitung.
Die 10 Sektionen:
- • Problembeschreibung: Mit Auswirkungsbewertung und Kostenschätzung
- • Sofortmaßnahmen: Eindämmung + FSCA-Bewertung (Sicherheitskorrektur)
- • Ursachenuntersuchung: 5-Warum mit Validierungs-Checkliste
- • Korrektur- & Vorbeugungsmaßnahmen: Inkl. verpflichtender horizontaler Ausweitung
- • RM-Akte-Prüfung: Brücke zu ISO 14971 Risikomanagement
- • Wiedereröffnung & Abschluss: Definierte Auslöser, Managementbewertung
📋 Verpflichtende horizontale Ausweitung – ein Top-Finding in FDA Warning Letters, jetzt fest im Formular verankert.
Ursachen finden – Root Cause Analysis Toolkit

Der häufigste CAPA-Fehler
"Menschliches Versagen" ist keine Root Cause. Oberflächliche Analyse führt zu unwirksamen Maßnahmen und Wiederholungsfunden.
Neu in v2.0:
- • 5-Why: Mit Grundursachen-Validierungs-Checkliste (Ja/Nein-Dropdown)
- • Ishikawa: 6M-Kategorien mit 4 Ursachenfeldern + Beschreibungen
- • Pareto: 15 Zeilen, automatische Kumulativ-% Berechnung
- • Methodenauswahl: NEU – Vergleichstabelle + Entscheidungshilfe
⚠️ Für CAPA mit Priorität Kritisch/Hoch: mindestens zwei komplementäre RCA-Methoden verwenden.
Überblick behalten – CAPA Tracking Log
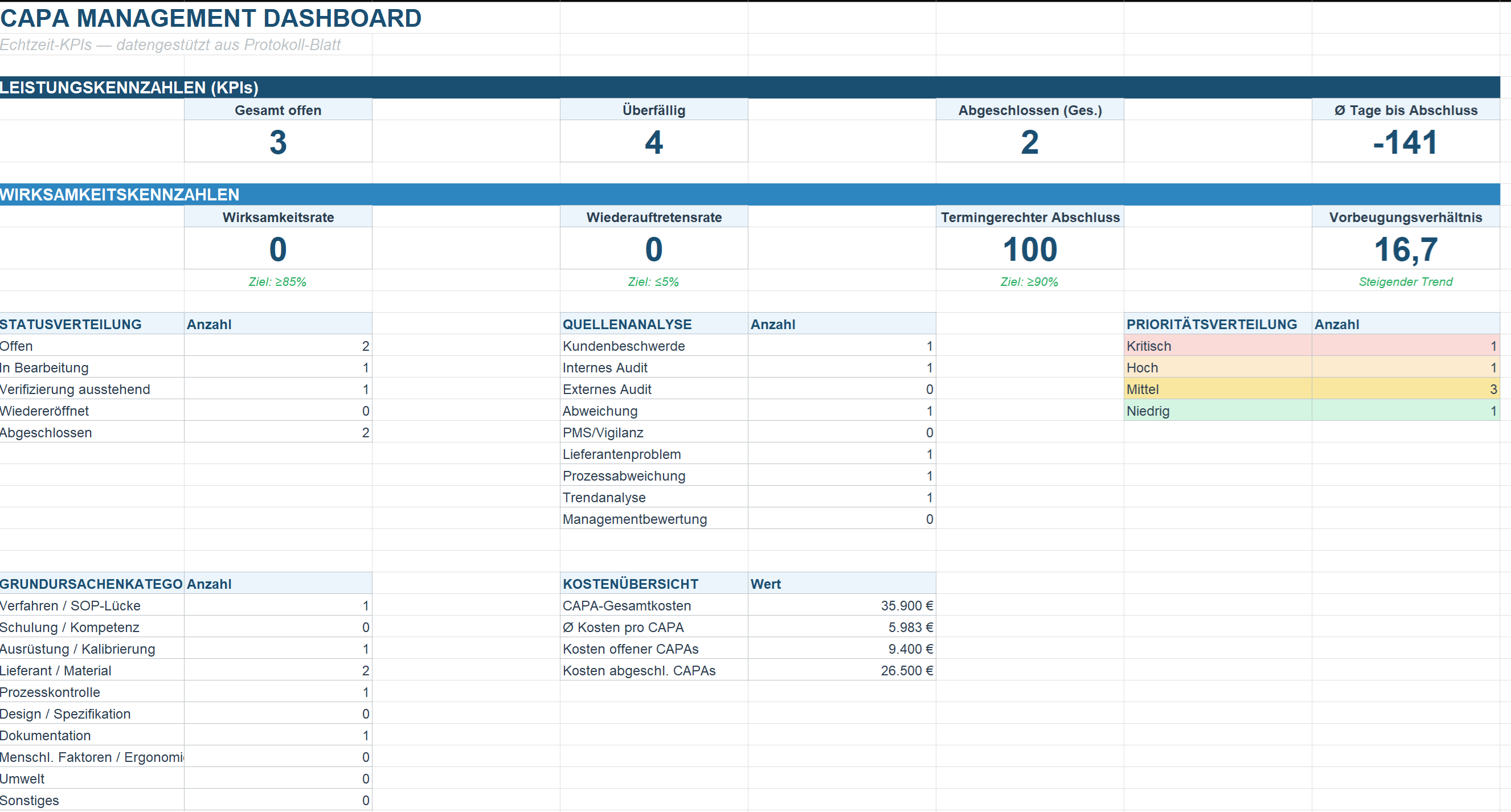
Zentrale Datenbank mit KPI-Dashboard
Version 2.0: 20 Spalten, 4 Blätter, bedingte Formatierung für Priorität, Status, Überfällig und Wirksamkeit.
Features:
- • Farbcodierung: Priorität, Status, Überfällig, Wirksamkeit – alles mit bedingter Formatierung
- • Dashboard: Leistungskennzahlen, Wirksamkeitsmetriken, Quellen-, Prioritäts- und Ursachenverteilung
- • Kostenübersicht: CAPA-Gesamtkosten, Ø pro CAPA, offene vs. abgeschlossene Kosten
Dashboard-KPIs:
- • Wirksamkeitsrate (Ziel: ≥85%)
- • Wiederauftretensrate (Ziel: ≤5%)
- • Termingerechter Abschluss (Ziel: ≥90%)
- • Vorbeugungsverhältnis (steigender Trend)
So sieht's fertig aus – Beispiel-CAPA
Lernen am Beispiel
Alle 10 Sektionen komplett ausgefüllt – vom Katheter-Etikettierungsproblem bis zur erfolgreichen Wirksamkeitsprüfung.
Das Szenario (Katheter UC-200):
- 1. Falsches Verfallsdatum auf 2.400 Einheiten gedruckt
- 2. 5-Warum-Analyse → SOP fehlt DHF/DMR-Verifizierungsschritt
- 3. Sofortmaßnahmen: Lot gesperrt, 12 Kunden benachrichtigt
- 4. Korrektur: SOP Rev 4, Checkliste erstellt, 6 Mitarbeiter geschult
- 5. Horizontale Ausweitung: 32 SKUs auditiert, UC-150 Diskrepanz gefunden
- 6. Vorbeugung: ERP-Automatisierung geplant, jährliches Etikettenaudit
- 7. Wirksamkeit: 92 Tage Monitoring, 0 Wiederholungen → WIRKSAM
✓ Inkl. RM-Akte-Prüfung, FSCA-Bewertung und Managementbewertungs-Abschluss – perfekte Trainingsreferenz.
Für den Schreibtisch – Quick Reference Card

Der Prozess auf einer Seite
Ausdrucken, aufhängen, fertig. Die Quick Reference fasst den gesamten CAPA-Prozess visuell zusammen.
Ideal für:
- • Neue Mitarbeiter im Onboarding
- • Reminder im Büro
- • Schnelle Referenz im Audit
- • Schulungen und Workshops
🖨️ Format: A4, druckoptimiert
CAPA funktioniert am besten im System
Nonconformances triggern CAPAs. Audits prüfen beides. Ein integriertes QM-System spart Zeit und besteht Audits.