Audit Preparation Kit
Audits sind stressig
Teams arbeiten bis zur letzten Minute an Dokumenten, Mitarbeiter wissen nicht was sie sagen dürfen, und niemand weiß genau wo die Lücken sind.
Das Problem: Unstrukturierte Audit-Vorbereitung führt zu Findings, die vermeidbar gewesen wären.
Die Lösung: Ein systematischer Audit-Prozess mit Interview-Guide, Checklisten und Pre-Check – damit Sie vor dem Auditor wissen, wo Sie stehen.
Das Kit führt Sie durch den kompletten Audit-Zyklus: Von der Planung über die Durchführung bis zum Reporting. Jedes Dokument ist audit-erprobt und direkt einsetzbar.
Sichere Zahlung via Gumroad · Sofortiger Download
Im Kit enthalten:
- ✓8 Dokumente (Word, Excel, PDF)
- ✓Interview Guide mit Red Flags
- ✓ISO + FDA Checklisten
- ✓Firmenweite Lizenz
Internal Audit SOP
Die Basis: Eine vollständige Verfahrensanweisung für Ihr internes Audit-Programm.
Was enthalten ist:
- • Audit-Programm Management
- • Auditor-Qualifikation & Unabhängigkeit
- • Major/Minor NC Klassifizierung
- • CAPA-Verknüpfung & Follow-up
- • Management Review Input
💡 Die SOP definiert klare Eskalationskriterien – so weiß jeder, wann ein Finding "Major" wird.
Audit Plan Template
Strukturierte Planung für jedes Audit – mit Risk-Trigger und Prozess-Scope.
Enthält:
- • Audit-Scope & Objectives
- • Risk-basierte Begründung
- • Zeitplan & Ressourcen
- • Auditor-Zuweisung
- • Dokumenten-Anforderungen
💡 "Why is this audit performed now?" – diese Frage beantwortet der Plan direkt.
Audit Report Template
Professionelle Audit-Berichte mit Finding-Klassifizierung und Regulatory Impact.
Report-Struktur:
- • Executive Summary
- • Finding-Details mit Evidenz
- • Regulatory Impact Assessment
- • CAPA-Referenzen
- • Follow-up Requirements
📋 Das "Regulatory Impact (Yes/No)" Feld hilft bei der Priorisierung.
Interview Guide
Der USP dieses Kits: Praxiserprobte Fragen für jeden QMS-Bereich – plus Red Flags.
Abgedeckte Bereiche:
- • Document Control & CAPA
- • Production & Quality Control
- • Design & Risk Management
- • Supplier Management
- • Cross-Functional Integration
⚠️ "Red Flag Answers" zeigen Ihnen, wann eine Antwort problematisch ist.
Audit Checklists
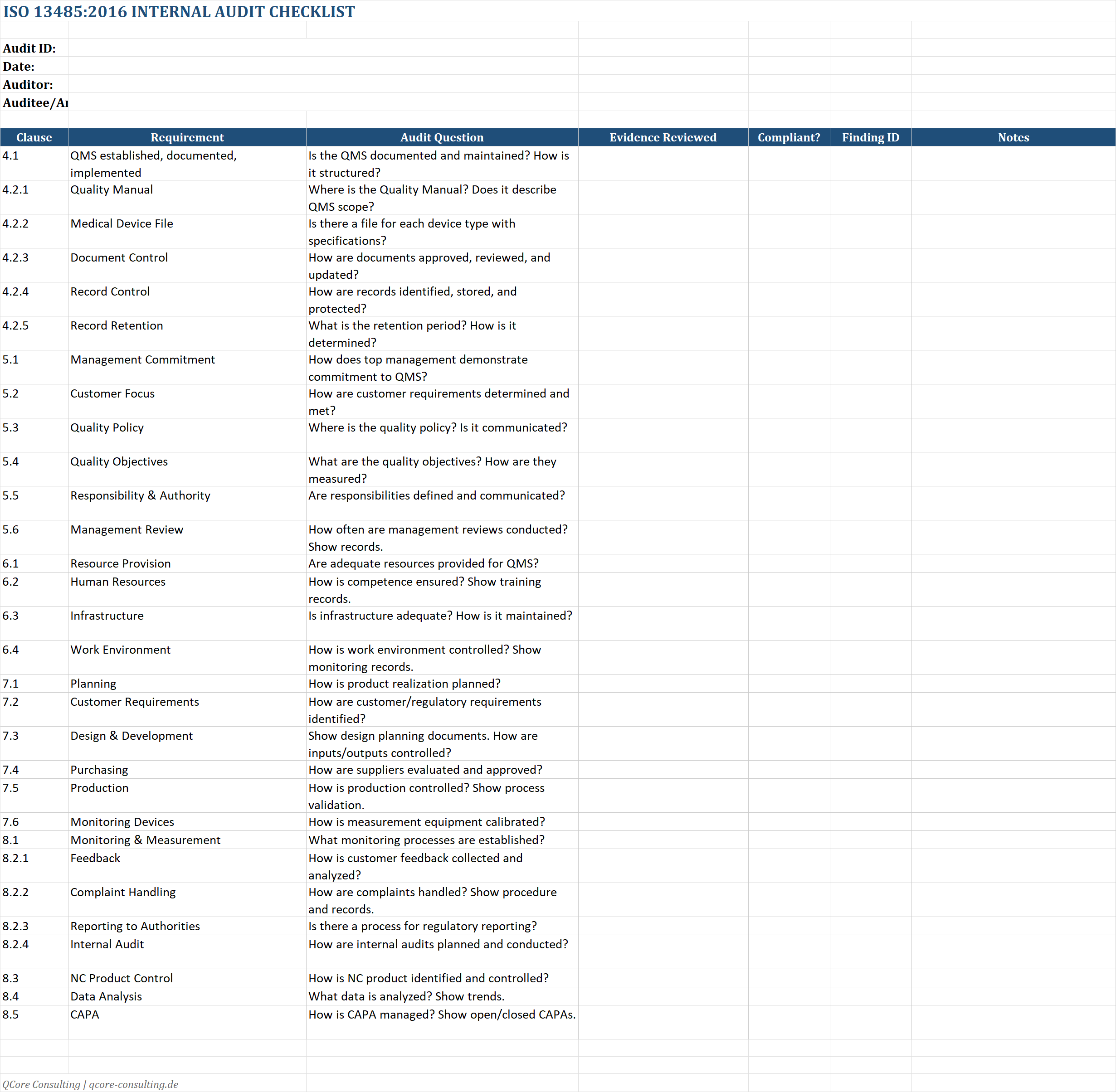
Umfassende Checklisten für ISO 13485 und FDA 21 CFR 820 – mit Objective Evidence.
Checklist-Features:
- • Alle relevanten Clauses
- • Objective Evidence Spalte
- • Status-Tracking (Compliant/NC/NA)
- • Kommentarfeld für Details
🔍 Zwei separate Checklisten – für ISO-fokussierte und FDA-fokussierte Audits.
Audit Schedule
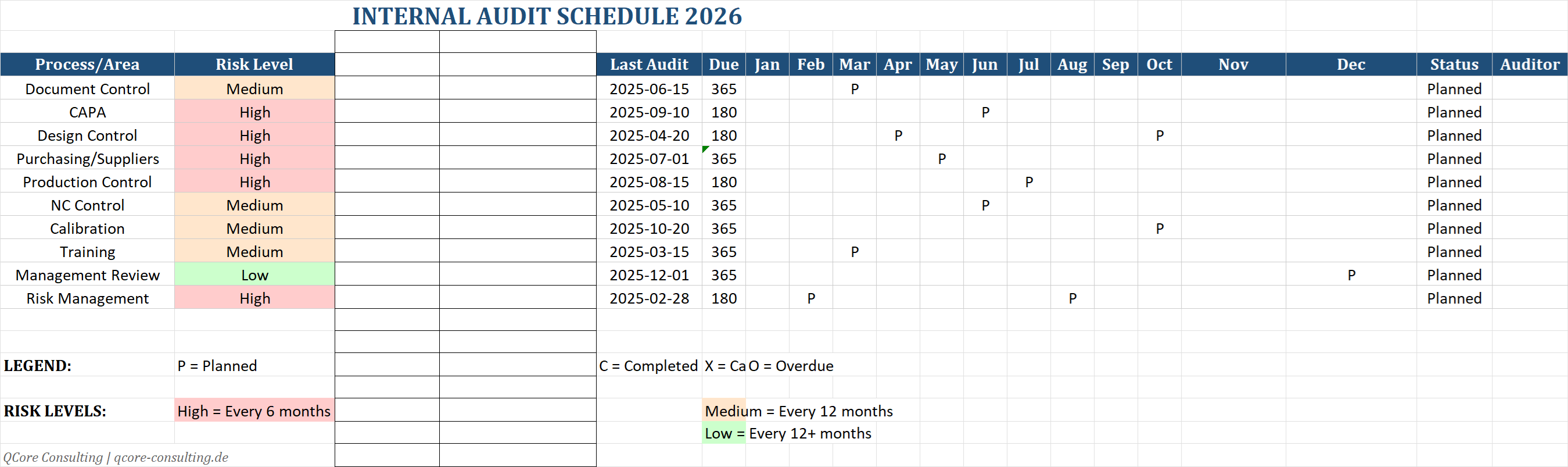
Visueller Zeitplan für die Audit-Durchführung mit Bereichen und Verantwortlichen.
Schedule enthält:
- • Prozess/Bereich-Zuordnung
- • Auditor-Zuweisung
- • Zeitslots
- • Ansprechpartner pro Bereich
📅 Verhindert Ad-hoc-Planung und sorgt für strukturierte Durchführung.
Quick Reference Card

Ein-Seiter für alle Mitarbeiter: Verhaltensregeln im Audit auf einen Blick.
Auf der Karte:
- • Do's und Don'ts im Audit
- • Eskalationswege
- • Kommunikationsregeln
- • Was Auditoren erwarten
🖨️ Drucken Sie diese Karte aus und verteilen Sie sie vor dem Audit an alle Bereiche.
Bereit für Ihr nächstes Audit?
€79 für strukturierte Vorbereitung – damit das Audit keine Überraschungen bringt.
Jetzt kaufen – €79Komplettpaket für Ihr QMS
Das Audit Prep Kit ist Teil unserer QMS-Bundle-Serie:
💡 Alle 3 Bundles zusammen: €307 statt €349 – Anfragen