CAPA System
#1 FDA Finding – Jahr für Jahr
CAPA-Mängel führen die Liste der FDA 483 Observations seit über einem Jahrzehnt an.
"Inadequate CAPA procedures" kostet Unternehmen Zertifizierungen, Kundenvertrauen und Marktzugang.
Das Problem: Die meisten CAPA-Systeme scheitern nicht an fehlenden Dokumenten – sondern an oberflächlicher Ursachenanalyse, unklaren Eskalationskriterien und fehlender Wirksamkeitsprüfung. Auditoren erkennen das sofort.
Die Lösung: Ein durchdachtes System mit klarer Struktur. Diese Anleitung zeigt Ihnen Schritt für Schritt, wie Sie ein CAPA-System aufbauen, das Audits besteht – mit Templates, die Sie sofort einsetzen können.
Scrollen Sie durch die 6 Schritte. Links sehen Sie das jeweilige Dokument als Vorschau, rechts die Erklärung zur Anwendung. Am Ende können Sie alle Dateien herunterladen.
Komplettes CAPA-Bundle – kostenlos gegen Email-Registrierung.
Download-Link per Email · Kein Spam
Enthalten:
- ✓7 Dokumente (Word, Excel, PDF)
- ✓Ausgefülltes Beispiel inklusive
- ✓RCA Toolkit (5-Why, Ishikawa, Pareto)
- ✓Firmenweite Lizenz
Den Prozess definieren – CAPA SOP
Warum zuerst die SOP?
Die SOP ist das Fundament Ihres CAPA-Systems. Ohne klare Prozessdefinition weiß niemand, wann ein CAPA gestartet wird und wer verantwortlich ist.
Was diese SOP regelt:
- • Trigger: Wann wird ein CAPA eröffnet?
- • Eskalation: Minor vs. Major vs. Critical
- • Verantwortlichkeiten: Wer macht was?
- • Fristen: Wie lange darf ein CAPA offen sein?
- • Schnittstellen: NC, Complaints, Management Review
💡 Die Entscheidungstabelle in §5.1.1 verhindert CAPA-Inflation – nicht jede NC braucht ein CAPA.
CAPAs dokumentieren – Das Formular
Ein Formular pro CAPA
Das Formular führt strukturiert durch den gesamten CAPA-Lebenszyklus – von der Problembeschreibung bis zum Abschluss.
Enthaltene Sektionen:
- • Header: ID, Datum, Quelle, Priorität
- • Problem: Was ist passiert? Impact?
- • Root Cause: Methode + Ergebnis
- • Actions: Corrective + Preventive
- • Verification: Wirksamkeitsnachweis
- • Closure: Freigaben + Unterschriften
📋 Alle Pflichtfelder nach ISO 13485 §8.5.2/8.5.3 und FDA 820.100 enthalten.
Ursachen finden – Root Cause Analysis Toolkit

Der häufigste CAPA-Fehler
"Menschliches Versagen" ist keine Root Cause. Oberflächliche Analyse führt zu unwirksamen Maßnahmen.
Das Toolkit enthält:
- • 5-Why: Strukturiertes Nachfragen
- • Ishikawa: 6M-Kategorien (Mensch, Maschine, Material, Methode, Messung, Mitwelt)
- • Pareto: 80/20-Regel anwenden
- • Anleitung: Welche Methode wann?
⚠️ Fragen Sie mindestens 5x "Warum?", bis Sie bei einem Prozess- oder Systemfehler landen.
Überblick behalten – CAPA Tracking Log
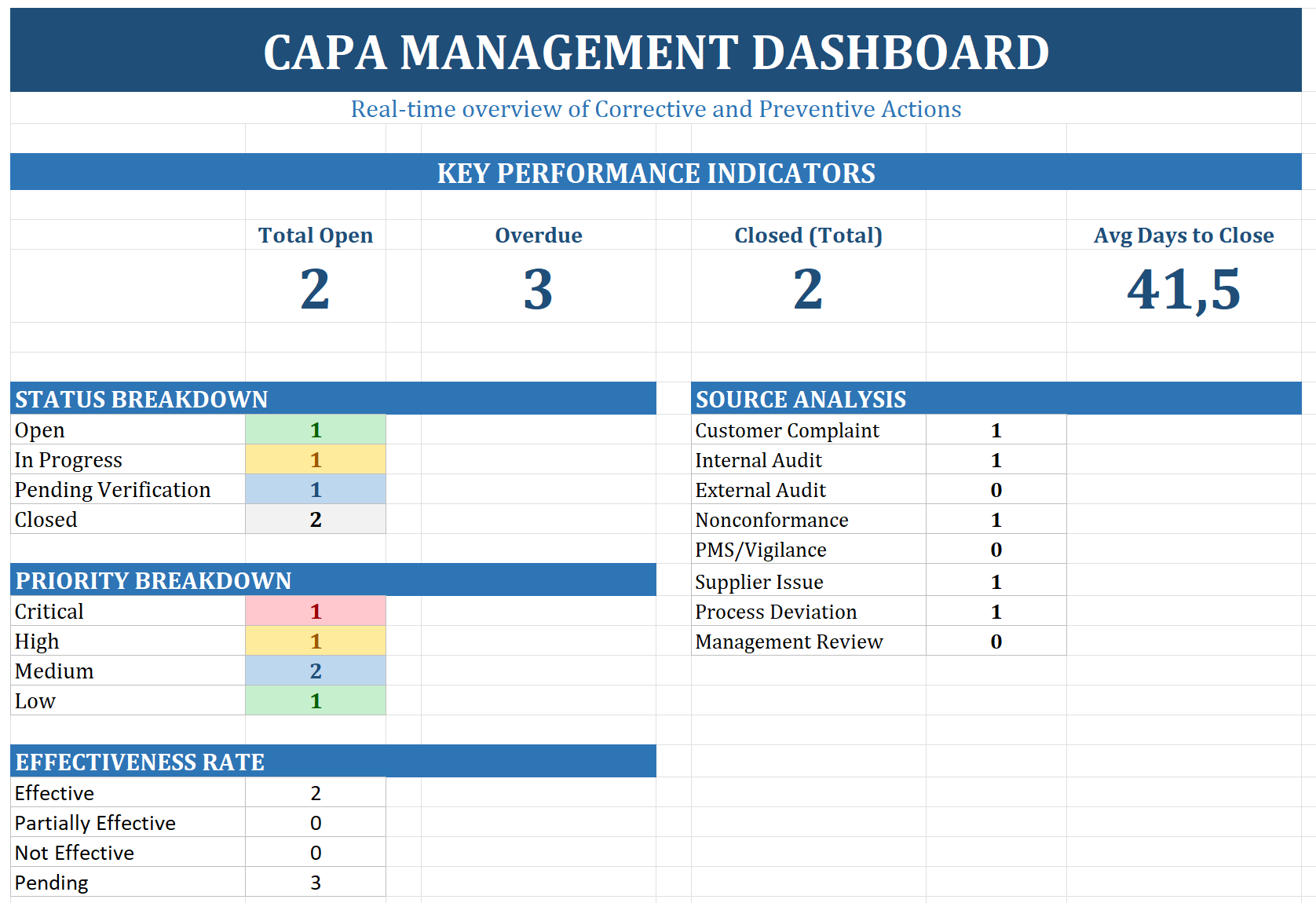
Das große Bild
Einzelne CAPAs sind wichtig – aber Sie brauchen die Gesamtübersicht. Der Log ist Ihre zentrale Datenbank.
Features:
- • Status-Tracking: Ampelfarben
- • Fristenüberwachung: Überfällig = rot
- • Dashboard: KPIs auf einen Blick
KPIs für Management Review:
- • Durchschnittliche Schließzeit
- • Anzahl überfälliger CAPAs
- • Verteilung nach Quelle
So sieht's fertig aus – Beispiel-CAPA
Lernen am Beispiel
Theorie ist gut, ein echtes Beispiel besser. Dieses komplett ausgefüllte CAPA zeigt, wie alles zusammenwirkt.
Das Szenario:
- 1. OOS-Befund bei Incoming Inspection
- 2. 5-Why-Analyse durchgeführt
- 3. Root Cause: Lieferant änderte Spec
- 4. Action: Lieferantenaudit + neue Prüfung
- 5. Prevention: Change-Notification-Agreement
- 6. Verification: 3 Monate Monitoring
- 7. Closure: Freigabe durch QM
✓ Eignet sich auch als Trainingsreferenz für neue Mitarbeiter.
Für den Schreibtisch – Quick Reference Card

Der Prozess auf einer Seite
Ausdrucken, aufhängen, fertig. Die Quick Reference fasst den gesamten CAPA-Prozess visuell zusammen.
Ideal für:
- • Neue Mitarbeiter im Onboarding
- • Reminder im Büro
- • Schnelle Referenz im Audit
- • Schulungen und Workshops
🖨️ Format: A4, druckoptimiert
CAPA funktioniert am besten im System
Nonconformances triggern CAPAs. Audits prüfen beides. Ein integriertes QM-System spart Zeit und besteht Audits.